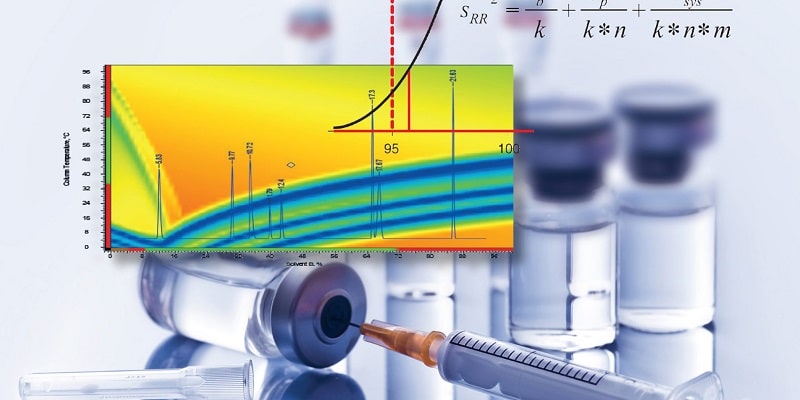
معتبرسازی روش های آنالیز چگونه انجام میشود؟
معتبرسازی روش های آنالیز به عنوان یکی از حیاتی ترین فعالیت ها در صنایع دارویی شناخته می شود. معتبرسازی روش های آنالیز به ما اثبات می کند که روش های انجام شده برای رسیدن به هدف مورد نظر از اعتبار کافی برخوردار می باشد یا خیر و نتیجه آن میزان بازده، ثبات، تناسب و اطمینان را اعلام می کند.
معتبرسازی روش های آنالیز
معتبرسازی روش های آنالیز چیست و با چه هدفی انجام می شود؟ معتبرسازی روش های آنالیز در صنایع حساس مانند صنعت داروسازی از اهمیت ویژه ای برخوردار است. زیرا بدین وسیله می توانیم مطمئن شویم که روش بکار رفته برای هدف موردنظر، به اندازه کافی معتبر است یا خیر. نتیجه تست معتبرسازی شامل میزان بازده، ثبات، تناسب و اطمینان است.
صنعت دارو به طور دائم در تلاش است تا با ایجاد فرمولاسیون های جدید، بتواند داروهای موثرتر و کم عارضه تری را تولید کند. باید فرمولاسیون جدید با دقت فراوان کنترل شود تا بتوان از آن به عنوان دارو یا ترکیب موثره استفاده کرد. معتبرسازی دارویی و احراز کیفیت به وسیله آزمون هایی انجام می شود که در گذشته بر روی فرآورده های مشابه صورت می پذیرفته است. امروزه مبحث توسعه روش های کنترل کیفی به عنوان یکی از داغ ترین مباحث در صنعت داروسازی محسوب می شود و در سراسر جهان مقالات متعددی در این زمینه نگاشته شده است. در ادامه به مهم ترین روش های معتبرسازی اشاره می کنیم.
معتبرسازی از دیدگاه سیستم های نظارتی
در خصوص ولیدیشن دارویی و معتبرسازی اتاق تمیز یک استاندارد جهانی به نام GMP وجود دارد که توسط سازمان FDA و سازمان های جهانی منتشر شده است. از مهم ترین سازمان های جهانی که در زمینه ارائه این استانداردها فعالیت می کنند ICH و WHO می باشد. با توجه به این موضوع که اغلب قوانین مورد تایید، به استانداردهای ICH مرتبط است، می توان گفت که اصلی ترین منبع برای معتبرسازی آزمون شناخته شده است. سازمان ICH تشکیل شده از مقامات نظارتی و صنایع تولیدی داروسازی است که در زمینه جنبه های علمی و فنی توسعه و ثبت ترکیب دارویی فعالیت می کند. مواردی که در ادامه به آن ها اشاره می کنیم در خصوص معتبرسازی از دیدگاه سیستم نظارتی می باشد.
– انجام هر گونه آنالیز، آزمایش و … مستلزم ارائه نتیجه برای توزیع فرآورده های دارویی است. در این پروسه باید دقت، ویژگی، تکرارپذیری و حساسیت روش های آزمایشی بکار گرفته شود. این پروسه باید مستند و پایه گذاری شود. مستندسازی باید بر طبق بخش 211.194 (a) انجام شود.
– این استاندارد به عنوان یک اصل کلی و تولیه برای تمام شرکت های تولیدکننده و کنترل کننده تلقی می شود که به منظور ایجاد استانداردهای عملکرد و اختصاصی است. دقت بیشتر و درنظر گرفتن نیازهای سازمان و فرآورده های مورد ارزیابی اهمیت دارد.

تصمیمات سازمان ICH Q14 در معتبرسازی آنالیز
منظور از استحکام در معتبرسازی روش های آنالیز چیست؟